Vom Molekül zum Arzneimittel

Wie wird ein neues Arzneimittel entwickelt?
Die Entwicklung eines neuen Arzneimittels erfordert technische Höchstleistungen, Knowhow, grosses Engagement – und einen langen Atem: Die durchschnittliche Entwicklungsdauer liegt bei mehr als zehn Jahren und kostet etwa 1 bis 2 Mrd. USD. Ist der Bedarf für ein neuartiges Arzneimittel für eine bestimmte Krankheit erkannt, steht zu Beginn die Entdeckung einer Substanz, die möglicherweise zur Heilung oder Linderung der Krankheit eingesetzt werden kann. Solche Substanzen können kleine Moleküle, also chemisch reine Verbindungen oder Extrakte pflanzlichen oder tierischen Ursprungs, oder mit Mitteln der Biotechnologie und genetisch veränderten Organismen hergestellte Biologika sein. Doch bis aus einer Substanz, die als Wirkstoff in Frage kommt, ein sicheres und zuverlässiges im Menschen wirksames Arzneimittel wird, ist ein langer Weg der Testung und Entwicklung notwendig. Viele Wirkstoffe scheitern: Von vielen tausend Substanzen, die von den Wissenschaftlern anfangs in Betracht gezogen werden, gelangt am Ende nur ein Wirkstoff als Arzneimittel auf den Markt.
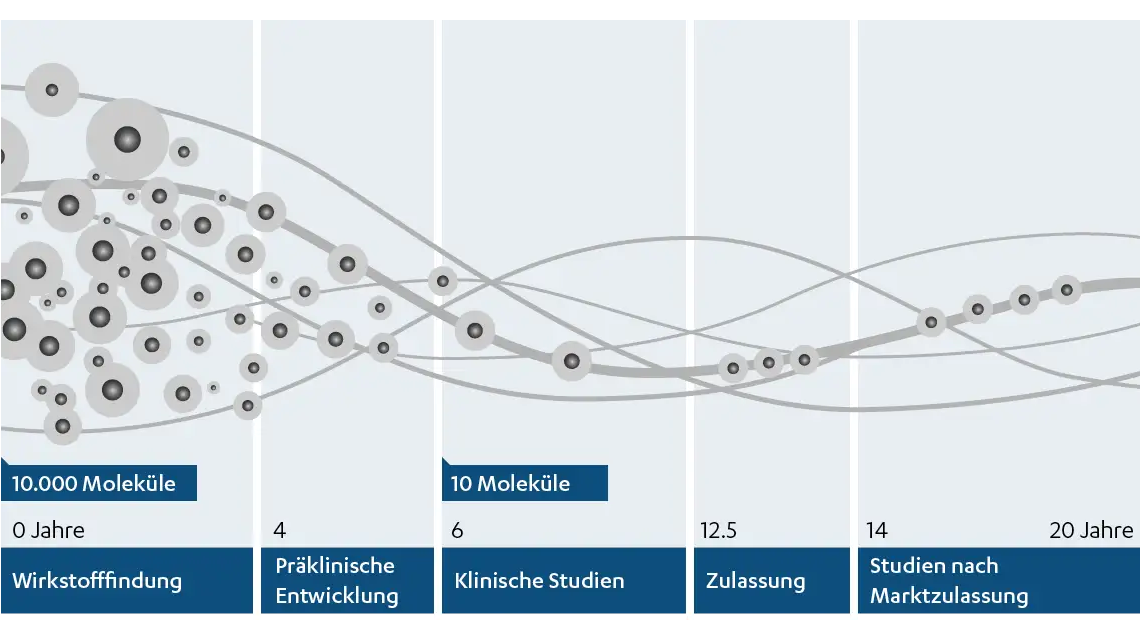
1) Die Suche nach einem neuen Wirkstoff
Oft bieten wissenschaftliche Erkenntnisse über die Ursache einer Krankheit einen Anhaltspunkt, um nach neuen Wirkstoffen zu suchen. Dem Wissen aus der Grundlagenforschung über die Funktion menschlicher Proteine, den kleinsten biologischen Bausteinen im menschlichen Körper, kommt dabei eine grosse Bedeutung zu. Denn Proteine, die in Krankheitsprozessen eine Rolle spielen, bieten mögliche Ziele (Targets) als Ansatzpunkte zur Behandlung einer Krankheit. In Zusammenarbeit der Fachbereiche Medizin, Chemie, Biologie und Informationstechnologie werden in aufwändigen Testzyklen an Zellkulturen im Labor und virtuell am Computer neue Substanzen gesucht und geformt, die an diese Targetproteine binden und ihre Funktion beeinflussen.
2) Präklinische Entwicklung
Ein aussichtsreicher Wirkstoffkandidat durchläuft ein umfassendes Untersuchungsprogramm. Erste Tests erfolgen im Reagenzglas und in Zellkulturen (in vitro). Wo es möglich ist, verzichtet Janssen auf Tierversuche und arbeitet zunehmend mit Zellkulturen oder noch kleineren Einheiten, den so genannten subzellulären Strukturen. Einige Eigenschaften können jedoch nur im Gesamtorganismus (in vivo) überprüft werden. Wirkstoffkandidaten, die die in vitro-Tests positiv durchlaufen haben, werden deshalb auch im Tiermodell geprüft.
Experten für Pharmakokinetik und Pharmakodynamik betrachten die Auswirkungen auf den Organismus und das Verhalten des Körpers auf den Wirkstoff. Neben Wirksamkeit wird auch Aufnahme, Verteilung und Ausscheidung/Abbau der Substanz im Tierkörper untersucht. Mit ausgeklügelten Versuchsanordnungen und Analysemethoden wird bewertet, wie sich die Testergebnisse vom Tier später auf den Menschen übertragen lassen (Translationale Wissenschaft).
Bei toxikologischen Untersuchungen steht vor allem die Sicherheit des Wirkstoffs für den Menschen im Fokus. Die Substanzen werden auf Herz und Nieren geprüft – schliesslich könnten neue Substanzen toxische Effekte auf den Körper haben, die Fortpflanzungsfähigkeit und Entwicklung von Embryonen beeinflussen, Krebs auslösen oder Veränderungen am Erbgut hervorrufen.
Erst wenn eine Substanz alle präklinischen Untersuchungen durchlaufen hat und als unbedenklich eingestuft wurde, darf sie auch am Menschen erprobt werden. Ausserdem muss über die Art der Verabreichung entschieden werden: Soll das Arzneimittel oral eingenommen oder injiziert werden? Auch die Möglichkeit, das potenzielle Arzneimittel in industriellem Massstab produzieren zu können, muss überprüft werden. Erst dann wird das Arzneimittel in die klinische Forschung übergeben.
3) Klinische Studien
Substanzen müssen ihre Wirksamkeit und Verträglichkeit beim Menschen in klinischen Studien bestätigen, bevor sie als Arzneimittel eine Marktzulassung erhalten können. Dabei wird zwischen Studien der Phasen I bis IV unterschieden, die in der Regel der Reihe nach durchlaufen werden müssen. Damit ein Wirkstoff in der richtigen Beschaffenheit und Dosis dem Menschen zur Verabreichung schliesslich bereitstehen kann, wird in diesem Zusammenhang auch die Darreichungsform (z.B. Tablette, Kapsel, Injektionslösungen, etc.) entwickelt (Galenik).
Auch nach Zulassung können weitere klinische Prüfungen sinnvoll sein, beispielsweise wenn der Hersteller die Zulassung für weitere Therapiefelder, Darreichungsformen oder Dosierungen anstrebt.
4) Zulassung
Im Zulassungsverfahren werden die vom Arzneimittelhersteller eingereichten Unterlagen zur pharmazeutischen Qualität, therapeutischen Wirkung und Unbedenklichkeit des Arzneimittels durch die zuständigen Behörden geprüft.
Die Zulassung für die Schweiz erteilt die Swissmedic.
5) Studien nach Marktzulassung
Nach der Zulassung ist es oftmals erforderlich, weitere Fragen zum Einsatz eines Arzneimittels unter Alltagsbedingungen zu beantworten. Dies kann im Rahmen von interventionellen klinischen Studien der Phase IV erfolgen oder durch nicht-interventionelle Studien, in denen das Arzneimittel gemäss üblicher Routine ohne Vorgabe studienspezifischer Untersuchungen eingesetzt wird.
Weitere Informationen rund um Arzneimittel erhalten Sie auf der Website von Interpharma.